Cosa sono gli acidi e le basi?
Acidi e basi
Cosa sono gli acidi e le basi?
In chimica due diversi tipi di sostanze sono chiamati acidi e basi che sono opposte l'una all'altra. Ciascuna di queste sostanze ha proprietà specifiche che modificano il comportamento delle soluzioni chimiche. Sia gli acidi che le basi possono essere trovati allo stato liquido, gassoso e solido (la polvere).
Quando acidi e basi si uniscono in una soluzione, si verifica una reazione esotermica, ovvero viene prodotto calore. Questa reazione è nota come neutralizzazione.
Cos'è un acido?
Gli acidi sono quelle sostanze che rilasciano ioni idrogeno positivi (H +) in una soluzione. Questa definizione è stata introdotta dallo scienziato Svante Arrhenius.
Un altro concetto, sviluppato dallo scienziato Gilbert Newton Lewis, definisce gli acidi come sostanze che possono ricevere o assorbire una coppia di elettroni dalla soluzione.
Come esempi di acidi possiamo citare quanto segue:
- Acido acetico o CH 3 COOH (aceto);
- acido ascorbico o C 6 H 8 O 6 (vitamina C);
- acido fosforico o H 3 PO 4 (presente nelle bevande analcoliche);
- acido lattico o C 3 H 6 O 3 (prodotto durante l'esercizio fisico);
- acido citrico o C 6 H 8 O 7 (arance, pompelmi, limoni, mandarini, ecc.).
Caratteristiche degli acidi
Tra le caratteristiche o proprietà degli acidi possiamo citare quanto segue:
- Hanno la capacità di distruggere i tessuti organici.
- Producono reazioni interagendo con determinati metalli.
- Agiscono come conduttori di corrente elettrica.
- Quando mescolati alle basi producono acqua e sale.
- Sono aspri da gustare.
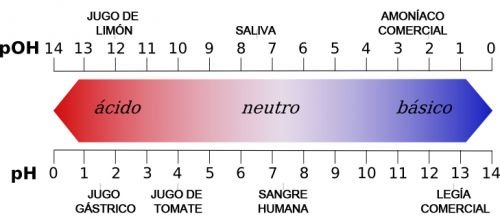
- Il pH degli acidi varia da 0 a 7 (dove 7 è neutro).
- Di solito sono solubili in acqua.
Tipi di acidi
- Acido forte: è quello che cede la maggior parte dei suoi ioni idrogeno in soluzione, il che significa che si ionizza molto facilmente. Ad esempio, HCl o acido cloridrico.
- Acido debole: a differenza del precedente, l'acido debole in soluzione acquosa rilascia ioni H + in misura minore. Ad esempio, acido acetico.
Cos'è una base?
Secondo Svante Arrhenius, le basi sono quelle sostanze che possono catturare gli ioni idrogeno in soluzione o rilasciare ioni negativi, chiamati idrossile (OH-).
Le basi sono anche definite come quelle sostanze che contribuiscono con due elettroni alla soluzione, secondo la teoria di Gilbert Newton Lewis.
Come esempio di basi , possiamo menzionare quanto segue:
- Idrossido di sodio o NaOH (soda caustica);
- idrossido di potassio o KOH (sapone);
- idrossido di alluminio o Al (OH) 3 (antiacido gastrico);
- idrossido di magnesio o Mg (OH) 2 (latte di magnesia);
- idrossido di calcio o CaOH (calce).
Caratteristiche delle basi
Tra le caratteristiche o proprietà delle basi possiamo citare:
- Scivolano al tatto quando si presentano in soluzione, cioè sono saponose (come la candeggina).
- Non reagiscono al contatto con i metalli.
- Sono conduttori di corrente elettrica in soluzione.
- Quando mescolati con acidi producono acqua e sale.
- Sono amari da gustare.
- Il pH delle basi varia da 7 a 14 (dove 7 è neutro).
- Alcune basi sono insolubili.
Tipi di basi
Nel campo delle basi sono noti almeno due tipi elementari:
- Base forte: si riferisce a una varietà di elettrolita a cui viene attribuito un carattere forte e può quindi essere completamente ionizzato in una soluzione acquosa. Ad esempio, la soda caustica.
- Base debole : si riferisce a quelle basi che non si dissociano completamente in soluzione acquosa, risultando in presenza di uno ione OH più il radicale basico. Ad esempio, ammoniaca o idrossido di ammonio.
.
Differenza tra acidi e basi
Una delle differenze più importanti tra acidi e basi è che gli acidi assorbono gli elettroni dalla soluzione in cui sono disciolti, mentre le basi li forniscono. Inoltre, gli acidi rilasciano ioni idrogeno positivi, mentre le basi rilasciano idrossile.
A causa di queste differenze, acidi e basi producono effetti diversi nelle soluzioni chimiche. Ad esempio, è consuetudine utilizzare la cartina di tornasole nei test del pH. La carta blu cangiante acquisisce toni caldi a contatto con acidi, cioè acquista tonalità rosa o rosse a seconda dell'intensità. Al contrario, quando una base reagisce con una carta iridescente rossastra, acquista tonalità blu.
- Data di aggiornamento: 6 marzo 2021.
Contenuti consigliati
- 13 caratteristiche del neoliberismo
- 60 qualità e difetti di una persona
- Cos'è il coprifuoco
- Cos'è il distanziamento sociale
- Cos'è un planisfero?
- Federazione: cos'è, caratteristiche, tipi
- Qual è il tasso di natalità?
- Qual è la bandiera Wiphala
- Qual è la tragedia greca?
- Quali sono le leggi degli esponenti?
- Quali sono le teorie della personalità?